А.В. Попа, В.И. Лифшиц, ХМ. Эмирова, Т.Ю. Абасеева, Д.В. Зверев, Т.Е. Панкратенко
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. Несмотря на то, что с момента описания ГУС Гассером прошло более 50 лет, вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются до настоящего времени недостаточно изученными и практически важными для клинической педиатрии. Исследования последнего десятилетия доказывают, что в основе механизма повреждения клеток эндотелия сосудов лежит чаще всего генетически обусловленная разбалан-сировка системы комплемента, что приводит к ее резкой активизации. Лечение атипичного ГУС остается малоэффективным. Прогноз, по-прежнему, неблагоприятен.
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. До настоящего времени вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются недостаточно изученными и важными для клинической педиатрии.
Выделяют типичный или постдиарейный ГУС (Stx-HUS) и атипичный ГУС (аГУС; Non-Stx-HUS). Если результаты лечения типичного ГУС успешны, то последствия атипичного ГУС остаются весьма неблагоприятными [1].
Non-Stx-HUS (аГУС) относится к группе тромботических микроангиопатий (ТМА), при которой почки являются основной мишенью в результате массивного повреждения эндотелия сосудов. Заболевание характеризуется микроангиопатической гемолитической анемией (МАГА) с тромбоцитопенией и почечной недостаточностью и отличается от Stx-HUS возрастом пациентов (<6 месяцев и >5 лет). Дебют аГУС может напоминать классическую тромботическую тромбоцитопеническую пурпуру (ТТП) — заболевание, при котором комбинация ТМА с тромбоцитопенией нередко сочетается с неврологическими симптомами, но обычно менее тяжелым поражением почек.
Развитие ТТП связывают с дефицитом протеазы фактора фон Виллебранда (ADAMTS 13), чаще в результате наличия антител, реже врожденной недостаточности энзима. Атипичный ГУС встречается в 5-10% от всех случаев ГУС, относится к тяжелым состояниям, склонным к рецидивам, с высокой летальностью и реальным риском развития терминальной стадии хронической почечной недостаточности (тХПН) [2, 3].
Несмотря на многообразие классификаций ГУС, в последнее время широко используется вариант, учитывающий отношение к шига-токсину (табл. 1) [1].

Симптомокомплекс аГУС имеет мультифакториальную природу, включая различные возбудители, не продуцирующие шигатоксин, а также вирусы, лекарственные препараты, злокачественные новообразования, трансплантацию, беременность, склеродермию, волчанку, антифосфолипидный синдром. Диарея у этих пациентов встречается редко. Результаты лечения этих форм неудовлетворительны. По разным данным, аГУС в 25% случаев заканчивается летально, в 50% — развивается тХПН или необратимое поражение ЦНС [4-7].
Спорадическая форма аГУС, развившаяся на фоне инфекции Streptococcus pneumonia, составляет около 40% случаев non-Stx-HUS и 4,7% всех случаев ГУС у детей в США [6]. Фермент нейраминидаза, продуцируемый S. pneumonia, удаляет сиаловые кислоты с клеточных мембран и обнажает антиген Thomsen-Friedenreich, тем самым, обеспечивая воздействие на него циркулирующих IgM, что приводит к агрегации тромбоцитов и повреждению эндотелия [8, 9]. Это тяжелое заболевание, сопровождающееся респираторным дистресс-синдромом, тяжелыми неврологическими расстройствами, при котором летальность достигает 50% [9].
Описано развитие non-Stx-HUS, вызванное противоопухолевыми (митомицин, цисплатин, блеомицин, гемцитабин), иммуносупрессивными (циклоспорин А, такролимус, ОКТЗ, хинидин) и антитромбоцитарными (тиклопидин, клопидогель) препаратами [10].
В литературе имеются сообщения о двух видах посттрансплантационного ГУС [2, 11]. Один из них возникает у пациентов впервые (de novo), другой — с тХПН, развившейся в результате перенесенного ГУС. Причинами развития посттрансплантационного ГУС, возникшего de novo, может служить применение ингибиторов кальцинейрина или отторжение по гуморальному типу (С4Ь-поло-жительное). Эта форма ГУС после трансплантации почки возникает у 5-15% пациентов, получающих циклоспорин А, и у 1% пациентов, получающих такролимус [12].
На фоне беременности при преэклапсии как осложнение могут развиться ГУС и поражение печени (HELLP-синдром), что служит показанием к экстренному родоразрешению, после которого наступает полная ремиссия [13]. Послеродовый ГУС, как правило, развивается в первые 3 месяца после родов. Летальность при этой форме составляет 50-60% [14].
Семейные формы аГУС составляют менее 3% всех случаев. Существует аутосомно-доминантная и аутосомно-рецессивная формы наследования [15]. При аутосомно-рецессивной форме аГУС дебютирует в раннем детском возрасте с рецидивирующим течением и высокой летальностью -60-70%. При аутосомно-доминантной форме в большинстве случаев заболевание начинается во взрослом возрасте, прогноз также неблагоприятный. Общий показатель смертности и тХПН составляет от 50 до 90% [15, 16].Около 50% случаев спорадического аГУС не позволяют обнаружить явного пускового момента (идиопатический ГУС) [2].
Патогенез
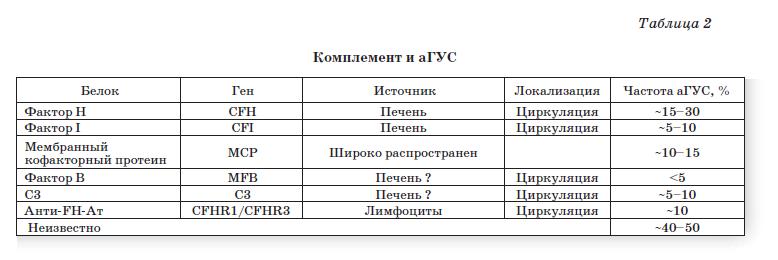
Исследованиями последнего времени документально подтверждено, что аГУС связан с генетическими нарушениями системы комплемента [5] (табл. 2).
Первые сообщения в мировой литературе о роли в патогенезе аГУС третьего компонента комплемента (СЗ) при семейной и спорадической формах появились еще в 1974 г. [16, 17]. Низкий уровень СЗ отражает его повышенное потребление в микроциркуляторном русле, что подтверждается обнаружением гранулярных отложений СЗ в клубочках и артериолах [18, 19]. Четвертая фракция комплемента (С4) находится в пределах нормы [16]. Описано снижение СЗ у здоровых родственников пациентов, страдающих семейным аГУС, что свидетельствует о наличии врожденного дефекта, приводящего к повышенной активации комплемента [16].
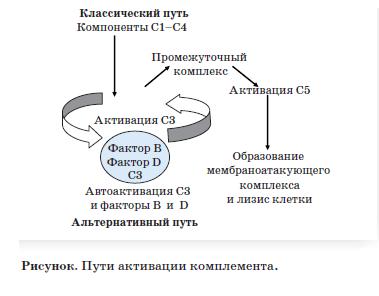
Выделяют три пути активации комплемента: классический, лектиновый и альтернативный (см. рисунок) [20, 21].
Поверхностные молекулы микроорганизмов активируют эти механизмы с образованием комплексов протеаз и СЗ конвертаз, расщепляющих СЗ до СЗЬ. Классическая и лектиновая конвертазы образуются из фрагментов С2 и С4, а конвертаза альтернативного пути требует СЗ. В случаях с низким уровнем СЗ и нормальным уровнем С4, которые чаще всего встречаются у пациентов с аГУС, можно сделать вывод об альтернативном пути активации комплемента у этих больных [16].
Альтернативный путь требует непрерывного контроля активности, так как находится в состоянии постоянной аутоактивации. Последовательность протеолитических шагов, вовлекающих СЗ, факторы В и D, усиливает активацию комплемента. Активация С5 приводит к образованию мембраноатакующего комплекса и лизису клетки. Активация контролируется ингибиторными белками, фактором Н и мембрано-связанным кофакторным протеином (МСР, известного как CD46). Фактор I является сериновой протеазой, которая инактивирует СЗЬ и С4Ь с кофакторами фактором Н и С4Ь-связывающим протеином. Нарушения были описаны в генах для большинства компонентов (фактор Н — у 30% больных, CD46 — у 10-15%, фактор I — в 10% случаев, фактор В, СЗ, фактор Н-связанные белки 1-5, тромбомодулин).
В 1998 г. P.Warwicker и соавт. [22] опубликовали результаты развития аГУС в трех семьях из-за связи с кластером генов на хромосоме Iq32, кодирующих ряд регуляторных белков комплемента. Первым изученным геном этого участка хромосомы стал фактор Н (HFI) [23, 24]. Фактор Н является мультифункциональным одноцепочечным гликопротеином плазмы крови с молекулярной массой 150 кДа, играет важную роль в регуляции альтернативного пути активации комплемента. HFI служит кофактором для фактора I (FI), регулирующего деградацию вновь образованных молекул СЗЬ, и контролирует разрушение, образование и стабильность СЗЬ-конвертазы (СЗЬВЬ).
В результате вирусной или бактериальной инфекции повреждается эндотелий сосудов с активацией комплемента и образованием СЗЬ. В случае отсутствия мутации HFI превращает СЗЬ в неактивную форму iC3b. В субэндотелиальном матриксе отсутствуют регуляторы комплемента, поэтому контроль за активацией комплемента в этой структуре полностью зависит от HFI. В инактивации СЗЬ участвует и МСР, расщепляя его до iC3b под действием FI [25, 26].
Мутантный HFI обладает нормальной кофакторной активностью в жидкой фазе. Однако мутация затрагивает участок взаимодействия с полианионами на С-конце HFI, что приводит к снижению способности данного фактора к связыванию с протеогликанами на поверхности эндотелиальных клеток и в субэндотелиальном матриксе. Тем самым увеличивается количество СЗЬ, получающего доступ к поверхности эндотелиальных клеток, так что концентрация МСР становится недостаточной для адекватного контроля активности комплемента на клеточной мембране. Кроме того, СЗЬ, откладываемый на обнаженном внеклеточном матриксе, не разрушается и образует СЗ-конвертазу альтернативного пути активации комплемента, усиливающую расщепление СЗ с образованием СЗЬ [25, 26].
Тогда как большинство мутаций приводят к дефектной функции регуляторных белков, мутации с усилением функции приводят к сверхактивации этого пути (суперфактор В). Мутантный фактор В приобретает способность связываться с инактивированным СЗЬ, что дает совершенно новый функциональный iC3Bb (СЗ конвертаза). Таким образом, даже если клеткам хозяина удалось заполучить фактор I для инактивации по¬верхностных отложений СЗЬ, мутантный фактор В будет использовать инактивированный СЗЬ для дальнейшей активации комплемента, приводя к клеточному повреждению [26].
В детском возрасте встречается и так называемый DEAP-HUS (Дефицит фактор Н-связанных плазменных белков и аутоантитело позитивная форма гемолитико-уремического синдрома), ключевыми признаками которого является наличие аутоантител к фактору Н и отсутствие фактор Н-связанных белков 1 и 3, обусловленное делецией 84-kbp фрагмента хромосомы 1. Лечение этого вида ГУС основывается на снижении титра антител с использованием плазматерапии, стероидов и иммуносупрессии.
Дефицит МСР также предрасполагает к развитию аГУС. Мутации МСР приводят к снижению поверхностной экспрессии или способности связывать СЗЬ. В обоих случаях мембраносвязанный СЗЬ инактивируется малоэффективно, что вызывает недостаточное усиление образования СЗЬ и отложение его на поврежденные эндотелиальные клетки посредством образования СЗ-конвертазы [25, 26].
В последнее время описывают еще один механизм регуляции активации комплемента — это мутации гена МСР, кодирующего мембранный кофакторный белок — связанный с клеткой регулятор комплемента [27, 28]. МСР является широко распространенным трансмембранным гликопротеином, выполняющим функцию кофактора для FI, расщепляющего СЗЬ и С4Ь на поверхности клеток хозяина [29-32]. В почках отмечается высокий уровень МСР, который обнаруживается на поверхности эндотелиальных клеток почечных клубочков [33-35]. По-видимому, МСР играет основную роль в защите гломерулярного эндотелия от активации СЗ. В настоящее время при аГУС изучается роль тромбомодулина-эндотелиального гликопротеина, обладающего антикоагулянтной, противовоспалительной и цитопротективной активностью.
In vitro тромбомодулин связывает СЗЬ и HFI, ингибируя активность комплемента и усиливая FI-обусловленную инактивацию СЗЬ в присутствии кофакторов — HFI и С4Ь-связывающего белка. Способствуя активации плазменной прокарбокси-пептидазы В, тромбомодулин усиливает инактивацию анафилатоксинов СЗЬ и С5а. Мутантный тромбомодулин обладает сниженной активностью к инактивации СЗЬ и в меньшей степени защищает от безудержной активации комплемента. По полученным данным, нарушение функции тромбомодулина встречается у 5% больных с аГУС [36].
Клиническая картина
ГУС клинически проявляется неиммунной МАГА, тромбоцитопенией и ОПН. Stx-HUS, как правило, развивается на исходе инфекционного гастроэнтероколита [2]. Средний промежуток времени между проникновением в организм инфекционного агента и развитием инфекционного процесса составляет от 1 до 8 суток [1, 37]. Кишечная инфекция манифестирует болями в животе, жидким водянистым стулом, часто со слизью и зеленью, в 70% случаев через 1-2 суток развивается гемоколит, более чем в 50% — повторная рвота [1, 37]. Фебрильная лихорадка встречается в 30-80% случаев.
Начало Stx-ГУС чаще всего наблюдается на фоне уменьшения степени выраженности диареи и проявляется резкой бледностью кожного покрова, петехиями, наличием пастозности, снижением объема мочи или ее полным отсутствием. Ребенок становится вялым, сонливым, резко снижается аппетит. В 25% случаев энцефалопатия проявляется клонико-тоническими судорогами, сопором, комой [1, 38, 39]. В патогенезе энцефалопатии играют важную роль одновременно несколько факторов: отек мозга, гипоксия, геморрагии.
Массивное внутрисосудистое потребление тромбоцитов может спровоцировать развитие коагулопа-тии потребления и развернутого ДВС-синдрома: гипер- или гипокоагуляция, гипопротромбинемия, гипофибриногенемия, повышение уровня продуктов деградации фибрина, Д-димера, замедленный фибринолиз, нарушение агрегации тромбоцитов.
В лабораторных показателях практически всегда обнаруживается анемия (Нв 40-90 г/л), тром-боцитопения (<150 000*109/л), гиперазотемия (мочевина >8 ммоль/л, креатинин >110 мкмоль/л), повышение уровня лактатдегидрогеназы; в мазке периферической крови: лейкоцитоз, фрагменти-рованные эритроциты (шизоциты), анизоцитоз, пойкилоцитоз, умеренно выраженный ретикулоцитоз. Для подтверждения неиммунного характе¬ра анемии выполняется реакция Кумбса, являющаяся отрицательной при ГУС [1, 40].
Учитывая, что патоморфологической основой ГУС является ТМА, в клинической картине могут присутствовать симптомы полиорганной недостаточности: поражение поджелудочной
железы, желудочно-кишечного тракта, легких, миокарда.
Атипичный ГУС манифестирует в раннем возрасте: при мутации FI — в возрасте 2 месяцев, HFI — 6 месяцев, МСР — старше года. Провоцирующим фактором к дебюту аГУС являются инфекционные агенты, в дальнейшем рецидивы возникают у 2/з больных независимо от генетического варианта. Причем промежуток между рецидивами может колебаться от нескольких недель до нескольких лет. Экстраренальные проявления при аГУС — чаще поражение ЦНС — выявляются в 20% случаев. Клинические проявления аналогичны таковым при Stx-HUS, но исход и прогноз значительно хуже и зависят от варианта мутации.
Диагностика
Установление диагноза аГУС обычно вызывает определенные затруднения в связи с тем, что не существует достоверных клинических отличий его от типичного ГУС и ТТП. Таким образом, для проведения дифференциальной диагностики пациенты с ГУС при поступлении в лечебное учреждение нуждаются в определении концентрации СЗ и фактора ADAMTS 13. В случае обнаружения дефицита фактора ADAMTS 13 в первую очередь нужно думать о ТТП. Однако нормальный уровень СЗ не исключает дисфункцию комплемента. Более чувствительным тестом является определение повышенного показателя отношения C3d/C3 в плазме крови и наличие отложения СЗ в биоптате почек [18, 19].
Для достоверной диагностики аГУС необходимо определение уровней факторов Н, I, В, D. Измерение уровня HFI в сыворотке крови позволяет выявить тех немногочисленных пациентов с мутациями HFI, вызывающими снижение уровня HFI. Снижение показателя СН50 и концентрации фактора В можно найти у некоторых, но не у всех пациентов с мутациями HFI или МСР. Второй этап состоит в поиске мутаций по генам HFI и МСР. Поиск мутаций фактора I следует проводить у пациентов с пониженным уровнем его в сыворотке крови [25, 26].
Лечение
Специфической терапии ГУС не существует. Лечение пациентов с Stx-HUS заключается в проведении заместительной почечной терапии (ЗПТ) в тех случаях, когда она показана с целью поддержания гомеостаза и обеспечения жизненно важных функций. Параллельно проводится посиндромная терапия, включающая регуляцию водно-электролитного баланса, коррекцию коагулопатии (трансфузии свежезамороженной плазмы — СЗП, антикоагулянты), коррекцию анемии (трансфузии эритроцитов). Причем применение СЗП также не является доказанно необходимым [21].
Зато применение тромбоцитной массы с заместительной целью во всех публикациях считается
неоправданным. Доказано, что трансфузии тромбоцитов способствуют и без того высокой склонности к образованию микротромбов и усилению ишемии тканей. Особенно значительно сказывается мик-ротромбообразование на состоянии ЦНС, усиливая неврологическую симптоматику. Трансфузии тромбоцитной массы считаются оправданными только в случае сочетания выраженной тромбоци-топении с профузным кровотечением.
По поводу антибактериальной терапии в литературе существует определенная дискуссия. Одни авторы [41] сообщают об увеличении риска развития ГУС в случае применения антибиотиков для лечения инфекции, вызванной Stx-E. coli, другие [42] публикуют результаты исследований, которые подобные факты не подтверждают. Представляется рациональным внутривенное введение антибактериальных препаратов широкого спектра действия для профилактики бактериальной инфекции при катетеризации центральных вен, имплантации перитонеального катетера и других оперативных вмешательствах, а также при наличии явного очага инфекции.
Неэффективным также признано внутривенное введение фибринолитиков, иммуноглобулинов, кортикостероидов, антиоксидантов и антитромбоцитарных препаратов [39] в острой фазе заболевания.
Были попытки использовать пероральный препарат SYNSORB, механизм действия которого основан на связывании шига-токсина [43]. Но проведенные клинические исследования не подтвердили достоверную эффективность этого препарата. В то же время многие авторы [44, 45] сообщают о снижении частоты развития тХПН после ГУС у детей, получавших малобелковую диету и ингибиторы ангиотензинпревращающего фермента (иАПФ). У этих детей отмечены уменьшение протеинурии, нормализация артериального давления и оптимизация скорости клубочковой фильтрации. В случае развития тХПН выполняется трансплантация почки. Риск развития повторного ГУС в этом случае составляет не более 10% [46].
Лечение пациентов с non-Stx-HUS отличается от лечения пациентов с типичным ГУС. Практически все источники сообщают об эффективности использования СЗП [47, 48]. Ежедневная доза СЗП колеблется от 20 до 40 мл/кг, трансфузии производятся до достижения ремиссии [2, 49]. В последнее время все большее распространение получает точка зрения об эффективности заменного плазмафереза. Многие авторы доказывают необходимость ежедневного плазмафереза длительное время [50].
В случае развития non-Stx-HUS, вызванного Streptococcus pneumonia, трансфузии СЗП противопоказаны из-за наличия в плазме взрослого человека антител против антигена Tromsen-
Friedenreich, которые утяжеляют течение процесса[1]. Если ГУС развивается на фоне приема циклоспорина или такролимуса необходимо отменить препарат.
Трансплантация почки в случае non-Stx-HUS малоэффективна. У 50% пациентов после трансплантации развивается ГУС в трансплантате [46]. В случае развития рецидива ГУС в трансплантате повторная трансплантация не производится.
Перспективные направления терапии
В настоящее время есть несколько направлений борьбы с ГУС. Одно из направлений — это создание препаратов, предупреждающих воздействие шига-токсина на организм. Есть сообщения об использовании в эксперименте на животных (мыши) рекомбинантных бактерий, на поверхности которых расположен рецептор к шига-токсину, связывающий токсин в кишечнике [51].
Другим перспективным направлением борьбы с ГУС является путь воздействия на систему комплемента, играющую важную роль в патогенезе ТМА. В настоящее время разрабатываются моноклональные антитела против фактора С5.
Пекселизумаб и Экулизумаб блокируют активацию компонентов комплемента. Проводятся клинические испытания растворимых форм ингибитора СЗ/С5-конвертазы, рецептора комплемента I (CRI) [52].
Для варианта с дефицитом HFI разрабатывается рекомбинантный HFI, а также возможность использования донорской плазмы, богатой HFI [25].Некоторые молодые больные (около 10%) имеют аутоантитела против фактора Н, особенно при наличии предрасполагающих мутаций в других компонентах комплемента. Некоторые больные с аГУС имеют дефицит ADAMTS 13. Эти результаты привели к разработке новых рекомендаций для диагностики и лечения с использованием ингибиторов альтернативного пути активации комплемента.
В настоящее время открыты новые горизонты терапии. Моноклональные антитела против С5, экулизумаб, показали свою эффективность в некоторых случаях ГУС (Gruppo RA). Другие терапевтические стратегии, которые исследуются в настоящее время, включают концентрат фактора Н, синтетический регулятор комплемента.
Прогноз
Действительно, одной из важных клинических проблем является определение критериев прогноза заболевания. Так как около 50% выживших после острого периода в дальнейшем нуждаются в ЗПТ и трансплантации почки, то и прогноз в значительной степени определяется риском возврата аГУС после трансплантации. Такой риск чрезвычайно высок у пациентов с мутациями CFH (-80%), CFI и СЗ (>50%). Описаны результаты 3 трансплантаций у пациентов с мутацией CFB — у всех отмечена гибель трансплантата в результате возвратного аГУС [53]. В случае мутации МСР подобного осложнения не происходит из-за отсутствия мутированного белка в трансплантате. Поскольку CFH, CFI, CFB и СЗ синтезируются в печени, рекомендуют осуществлять комбинированную трансплантацию печени и почки или изолированную трансплантацию печени в случае отсутствия почечной недостаточности.
Заключение
Атипичный ГУС — тяжелое состояние с очень высокой смертностью и большим риском развития ХПН. Наиболее эффективным методом терапии признано проведение заменного плазмафереза в начале острого периода. Некоторое улучшение результатов лечения пациентов с аГУС обусловлено активным изучением патогенеза этого тяжелого заболевания в последние годы.
Источник: http://www.evrika.ru/article/775